Acyl-Carrier-Protein
Definition
Das Acyl-Carrier-Protein, kurz ACP, spielt eine wichtige Rolle in der Fettsäuresynthese. Es ist Teil der Fettsäuresynthase, einem Multienzymkomplex, in dem alle Enzyme der Fettsäuresynthese lokalisiert sind.
Struktur
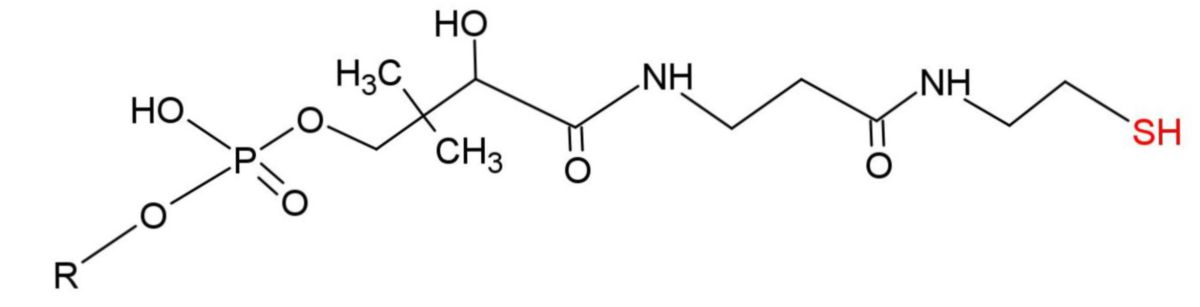
Die Struktur des Acyl-Carrier-Proteins besteht hauptsächlich aus 4 α-Helices, die untereinander durch Loops verbunden sind. Als prosthetische Gruppe besitzt es eine Phosphopantetheingruppe.
Diese Phosphopantetheingruppe bietet gleich zwei Vorteile:
- Die kovalente Bindung (Thioester) ist stabil.
- Die lange Kette ist flexibel und bietet dem Substrat trotz Bindung Zugang zu den sterisch anspruchsvollen aktiven Zentren einiger Enzyme.
Funktion
Im ersten Schritt der Fettsäuresynthese wird durch die Malonyl-Acetyl-Transferase die Acetylgruppe eines Acetyl-CoA auf die Phosphopantetheingruppe des Acyl-Carrier-Proteins übertragen. Die Acetylgruppe wird durch Ausbildung eines Thioesters auf die β-Ketoacyltransferase übertragen, die im aktiven Zentrum einen Cysteinrest besitzt. Auf das jetzt wieder freie Acyl-Carrier-Protein wird eine Malonylgruppe übertragen.
Die β-Ketoacyltransferase kondensiert anschließend die Acetylgruppe mit der Malonylgruppe. Das Kondensationsprodukt, Acetacyl-ACP, durchläuft nun die restlichen Schritte der Fettsäuresynthese und die Acyl-Hydrolase spaltet im letzten Schritt das Acyl-Carrier-Protein von der fertigen Fettsäure ab.