Replikationsfaktor C
Synonyme: Clamp loader, Klammerlader
Englisch: replication factor C
Definition
Der Replikationsfaktor C, kurz RFC, ist ein Proteinkomplex, der für die Ladung des Ringklemmenproteins PCNA auf die DNA während der Replikation verantwortlich ist.
Genetik
Der Replikationsfaktor C wird durch fünf Gene codiert.
| Genname | Genlokus | Exons | Molekulargewicht |
|---|---|---|---|
| RFC1 | 4p14 | 25 | 140 kD |
| RFC2 | 7q11.23 | 11 | 40 kD |
| RFC3 | 13q13.2 | 15 | 38 kD |
| RFC4 | 3q27.3 | 11 | 37 kD |
| RFC5 | 12q24.23 | 14 | 36 kD |
Struktur
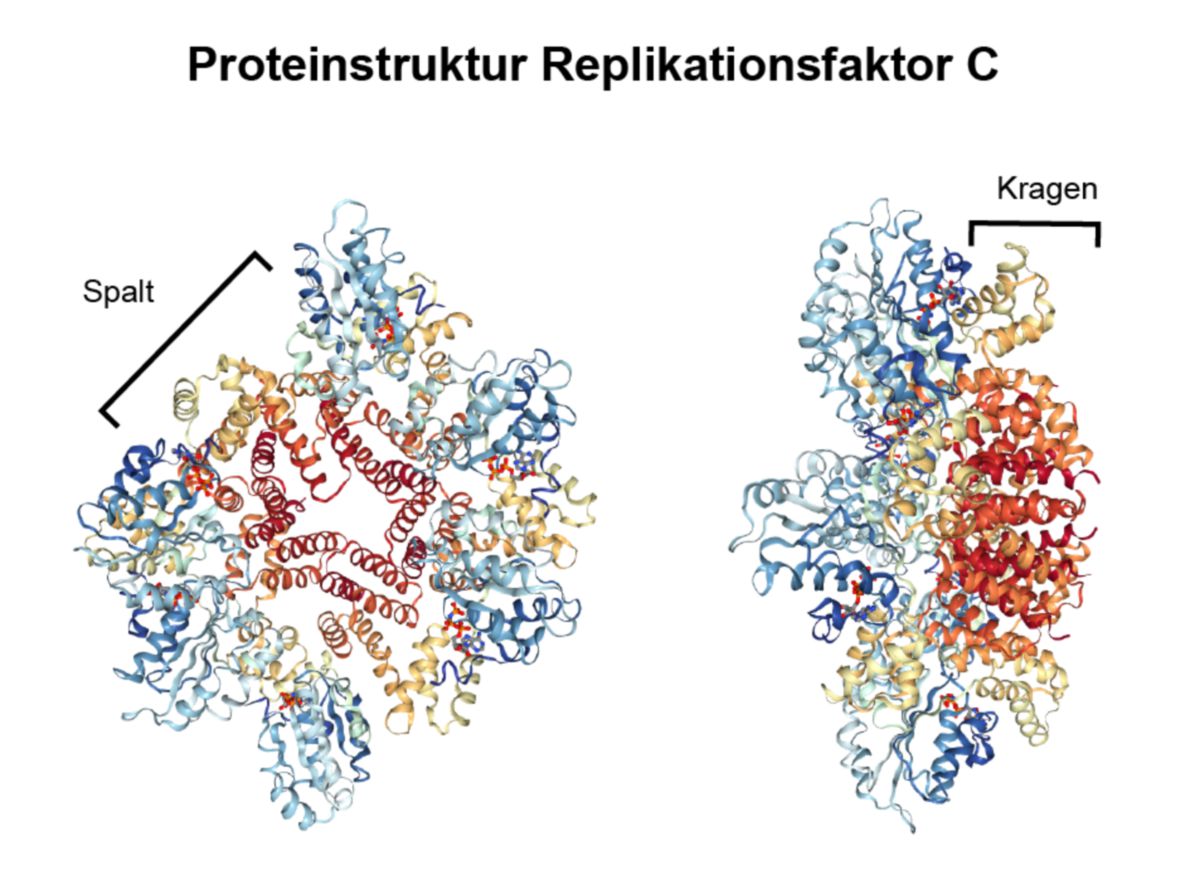
Der RFC ist ein heteropentamerer Proteinkomplex. Die fünf Untereinheiten sind ringförmig angeordnet, jedoch verbleibt ein Spalt zwischen RFC1 und RFC5. Durch diese Anordnung der Untereinheiten entsteht eine deckelförmige Struktur, die auf das 3'-Ende der DNA binden kann. Der Spalt ermöglicht dem Molekül, spezifisch die Grenze von einzelsträngiger zu doppelsträngiger DNA zu finden. Im Spalt verläuft der andere Strang. Der C-Terminus der Untereinheiten ist in die gleiche Richtung orientiert und bildet eine Struktur, die als Kragen bezeichnet wird (Englisch: "collar").
Die größte Untereinheit (RFC1) bindet direkt an 3'-Ende der DNA. RFC3 vermittelt die Interaktion zwischen dem Kernkomplex und der großen Untereinheit. Alle Untereinheiten besitzen ATP-Bindungsmotive, wodurch ATP im Molekül koordiniert wird. Die kleinste Untereinheit (RFC5) interagiert mit der C-terminalen Region von PCNA, wodurch dieses sich öffnet und auf die DNA-geladen werden kann.[1]
Biochemie
Die fünf RFC-Untereinheiten gehören alle zu den AAA+-Proteinen. Dies ist eine Klasse von ATPasen, die ein ähnliches katalytisches Zentrum zur Hydrolyse von ATP besitzen. Die Energie aus der ATP-Spaltung wird genutzt, um in ihrem gebundenen Substrat eine Konformationsänderung herbeizuführen.[2]
Funktion
Hat der RFC ATP gebunden, befindet er sich in einem geladenen Zustand (Englisch: "primed") und kann das Ringklemmenprotein PCNA binden. Dieser RFC-PCNA-Komplex hat eine hohe Affinität für freie 3'-Enden, wie sie während der Replikation durch die Aktivität der Primase entstehen. Es konnte gezeigt werden, dass PCNA auf die DNA geladen wird, indem seine Ringstruktur geöffnet wird. Sobald dieser Komplex an die DNA gebunden hat, wird ATP hydrolysiert und RFC löst sich von PCNA und DNA. Der Ring von PCNA geht in seine geschlossene Form über und kann nun die DNA-Polymerasen auf die DNA laden.[3]
siehe auch: PCNA
Quellen
- ↑ Bowman Gregory D.,Goedken Eric R.,Kazmirski Steven L.,O’Donnell Mike and Kuriyan John(2005), DNA polymerase clamp loaders and DNA recognition, FEBS Letters, 579, doi: 10.1016/j.febslet.2004.11.038
- ↑ James D. Watson: Molekularbiologie. Pearson Studium, 2011, S. 261-262.
- ↑ Schauer G, Finkelstein J, O'Donnell M. Bio Protoc. 2017 Sep 20;7(18). pii: 2548. doi: 10.21769/BioProtoc.2548.