Hämostase
von altgriechisch: αἷμα ("haíma") - Blut; στάσις ("stasis") - Stillung
Synonyme: Blutstillung, Blutgerinnung
Englisch: h(a)emostasis, blood clotting
Definition
Als Hämostase bezeichnet man die Summe der physiologischen Prozesse, die den Stillstand einer Blutung herbeiführen.
Im erweiterten Sinn wird auch die ärztliche Blutstillung durch Gefäßnähte, Kompressionsverbände oder Hämostyptika als "Hämostase" bezeichnet.
Überblick
Die Hämostase ist eine lebenswichtige Funktion. Durch sie ist der Körper in der Lage, Schäden in Gefäßen abzudichten und somit einen Blutverlust zu reduzieren bzw. zu verhindern. Nach Verletzung kleinerer Gefäße wie Kapillaren kommt eine Blutung in der Regel bereits nach kurzer Zeit zum Stillstand. Die Hämostase kommt durch das Ineinandergreifen von drei Schritten zustande:
- Der erste ist eine Vasokonstriktion des verletzten Gefäßes, u.a. hervorgerufen durch freigesetztes Serotonin und Thromboxan mit einer nachfolgend verringerten Blutzirkulation.
- Die verlangsamte Strömungsgeschwindigkeit im verletzten Gefäß unterstützt den zweiten Schritt: die Adhäsion und Aktivierung der Thrombozyten.
- Als letzter Schritt verschließt, als Endprodukt der plasmatischen Gerinnungskaskade, ein Aggregat aus Fibrinpolymeren und Thrombozyten, den verletzten Gefäßabschnitt.
Einteilung
Man kann die drei Schritte der Hämostase in zwei Phasen einteilen, die primäre und die sekundäre Hämostase. Die verschiedenen Phasen der Hämostase laufen nicht – wie in der idealisierten Modellvorstellung – streng sequentiell ab, sondern gehen in vivo fließend ineinander über.
Primäre Hämostase
Die primäre Hämostase sorgt für eine Stillung der Blutung nach 1 bis 3 Minuten und lässt sich im klinischen Alltag durch die Bestimmung der Blutungszeit überprüfen.
Vasokonstriktion
Der erste Schritt der primären Hämostase ist eine Vasokonstriktion der verletzten Gefäße, sie wird durch bestimmte Stoffe wie z.B. Endothelin-1 ausgelöst. Sie führt zu einer Verengung der Gefäßabschnitte vor der Läsion und damit zu einer Verlangsamung des Blutstroms im Verletzungsgebiet, welche die hämodynamische Grundlage der weiteren Abläufe ist.
Thrombozytenadhäsion
Im weiteren Verlauf kommt es zu einer Thrombozytenadhäsion an bestimmte Komponenten des verletzten Gefäßendothels, z.B. Kollagen und Fibronektin. Sie wird über Glykoprotein Ib (GPIb) bzw. Glykoprotein Ic/IIa (GPIc/IIa) vermittelt. GPIb ist der wichtigste Adhäsionsrezeptor für den von-Willebrand-Faktor (vWF), der das Bindeglied zwischen den Thrombozyten und dem subendothelialen Kollagen ist. Die Adhäsion der Thrombozyten sorgt für eine erste, dünne Bedeckung der Wunde.
Thrombozytenaktivierung
Durch die Adhäsion an subendotheliale Strukturen werden die Thrombozyten aktiviert. Die wichtigsten Aktivatoren sind Kollagen, Thrombin, ADP, Adrenalin sowie das von aktivierten Thrombozyten selbst gebildete Thromboxan A2 (TXA2). Sie stoßen intrazelluläre Signalkaskaden an.
Der proaggregatorische Signalweg von TXA₂ beginnt mit der Bindung an den Thromboxan-A₂-Rezeptor (TP-Rezeptor), einen Gq-gekoppelten Rezeptor. Er aktiviert die Phospholipase C mit nachfolgender Bildung von IP₃ und DAG. Dadurch erhöht sich die intrazelluläre Calciumfreisetzung (Ca2+) und die Proteinkinase C wird aktiviert.
Darauf bilden die Thrombozyten infolge einer Aktinreorganisation Pseudopodien aus. Parallel kommt es zu einer Degranulation bzw. Exozytose der dichten Granula und einer Aktivierung intrazellulärer Enzymsysteme. Die Bildung von Pseudopodien vergrößert die Kontaktfläche und erleichtert die Plättchen-Plättchen-Interaktion.
Aus den α‑Granula und δ‑Granula werden Mediatoren freigesetzt. Die α‑Granula enthalten beispielsweise Fibrinogen, vWF und Faktor V, die δ‑Granula vor allem ADP, Ca2+ und Serotonin. Diese Substanzen verstärken autokrin und parakrin die Aktivierung benachbarter Thrombozyten.
Ein weiterer Schlüsselvorgang der Aktivierung ist die Konformationsänderung des Glykoprotein-Rezeptorkomplexes GPIIb/IIIa. Erst in seiner aktiven Form kann er Fibrinogen, vWF und Fibronectin binden.
Zusätzlich wird durch die Translokation negativ geladener Phospholipide, vor allem Phosphatidylserin, an die Außenseite der Zellmembran eine prokoagulatorische Oberfläche geschaffen, welche die Aktivierung der Gerinnungsfaktoren (vor allem von Faktor X und Prothrombin) katalysiert.
Thrombozytenaggregation
Die aktivierten Thrombozyten interagieren über den GPIIb/IIIa-Rezeptor (αIIbβ3-Integrin), der durch Konformationswechsel in seiner aktiven, fibrinogenbindenden Form auf der Oberfläche exprimiert wird. Dieser Rezeptor vermittelt die Querverknüpfung mehrerer Thrombozyten durch Fibrinogen (primärer Brückenligand) sowie in geringerem Umfang durch vWF und Fibronectin, wodurch die primäre Thrombozytenaggregation eingeleitet wird.
Zu Beginn ist die Aggregation reversibel und durch schwache intermolekulare Bindungen gekennzeichnet. Durch die autokrine/parakrine Wirkung akkumulierender Mediatoren (ADP, TXA₂, Thrombin) entsteht ein positives Feedback, das zur irreversiblen Aggregation und Ausbildung eines stabilen Thrombozytenpfropfs ("weißer Thrombus") führt.
Im weiteren Verlauf kommt es zur viskösen Metamorphose: Die Thrombozyten verlieren ihre Membranintegrität, setzen prokoagulatorisches Phosphatidylserin frei und werden im Fibrinnetz des sekundären Hämostase-Thrombus verankert. Dadurch entsteht ein vorübergehend verschlossener Abscheidungsthrombus, der die Grundlage für die fibrinvermittelte Stabilisierung bildet.
Sekundäre Hämostase
Die sekundäre Hämostase ist die eigentliche Blutgerinnung. Sie nimmt etwa 6 bis 10 Minuten in Anspruch und führt zur Ausbildung eines festen Fasernetzes aus Fibrin, in das Thrombozyten und Erythrozyten eingebettet sind. Es ist makroskopisch ein Thrombus. Man unterscheidet nach Morawitz drei Phasen:
- Aktivierungsphase
- Koagulationsphase
- Retraktionsphase
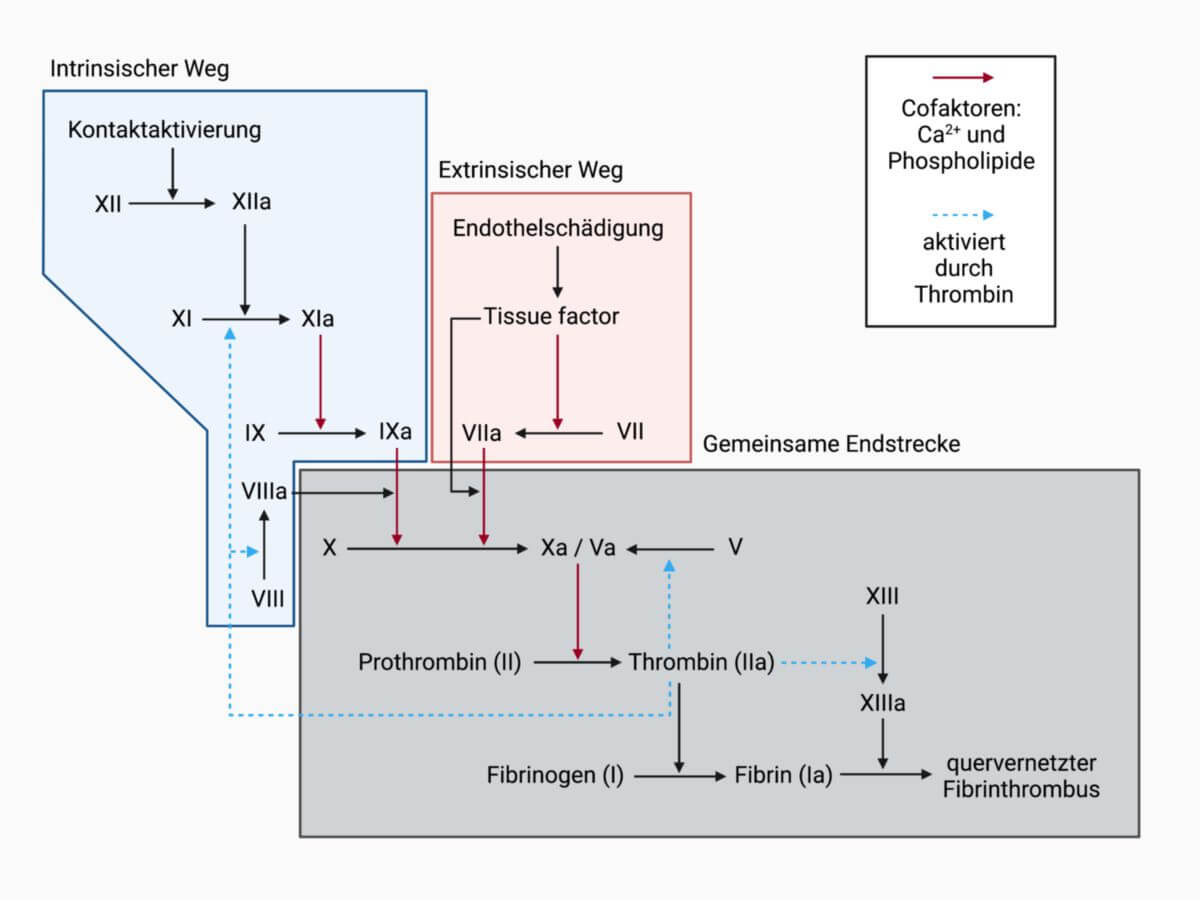
Nach dem klassischen Modell kann man zwei Systeme differenzieren, die intrinsische und die extrinsische Gerinnungskaskade. Bei beiden Systemen kommen die Gerinnungsfaktoren zum Tragen, die in einem treppenartigen Ablauf jeweils die Aktivierung eines oder mehrerer nächster Faktoren induzieren.
Der Endschritt der extrinsischen wie der intrinsischen plasmatischen Gerinnungskaskade ist die Fibrinpolymerisation. Beide Systeme münden über die Bildung von Faktor X letztendlich in die Thrombinbildung (Faktor II), was wiederum die Entstehung von Fibrinogen und dessen Polymerisation anregt.
Aus didaktischen Gründen wird die plasmatische Gerinnung weiterhin in eine extrinsische und eine intrinsische Gerinnungskaskade unterteilt. Es zeigen sich aber zunehmend mehr Wechselwirkungen der beiden Systeme. Ergänzend zum klassischen Kaskadenmodell wird deshalb heute (2026) zunehmend das zellbasierte Modell der Gerinnung verwendet, das die Gerinnung als Initiations-, Amplifikations- und Propagationsphase auf unterschiedlichen Zelloberflächen beschreibt.
Intrinsisches System
Das intrinsische System besteht überwiegend aus den Reaktionen an der Oberfläche aktivierter Thrombozyten und unterhält die weitergehende Fibrinbildung. Der intrinsische Weg spielt im klinischen Alltag eine große Rolle, da er eine Gerinnung ohne Freilegung der subendothelial gelegenen Strukturen, beispielsweise durch liegenden zentralen Venenkatheter oder künstlichen Herzklappen, triggert.
Der intrinsische Weg der Blutgerinnung startet über den Hageman-Faktor (Faktor XII). Seine Aktivierung wird über eine Bindung an negativ geladenen Oberflächen initiiert. Des Weiteren unterstützt er über aktives Kallikrein seine eigene Aktivierung. Faktor XI wird durch den aktivierten Hageman-Faktor und über positive Rückkopplung durch Thrombin aktiviert. In der Folge wird Faktor IX durch den aktivierten Faktor XIa aktiviert. Dieser bildet nun mit Faktor VIIIa einen Enzymkomplex, der intrinsischer Tenasekomplex oder Xase-Komplex genannt wird. Er aktiviert in der Folge Faktor X und mündet damit in die gemeinsame Endstrecke der Gerinnungswege.
Faktor VIII ist ein multimeres Glykoprotein, das in Endothelzellen und Megakaryozyten synthetisiert wird und sich im Plasma und in Thrombozyten nachweisen lässt. Er steigert die Aktivierung von Faktor X in der intrinsischen Gerinnungskaskade um bis zu drei Zehnerpotenzen und mehr. Um diese Funktion ausüben zu können, muss Faktor VIII mithilfe von Thrombin aus seinem Kofaktor und Trägerprotein, dem von-Willebrand-Faktor, herausgelöst werden.
Der von-Willebrand-Faktor führt den Faktor VIII an den Ort der Blutung und stellt eine Verbindung zwischen den Glykoproteinrezeptoren GPIIa und GPIIb/IIIa der Thrombozyten und dem Endothel her.
Extrinsisches System
Das auslösende Ereignis ist meist geschädigtes Endothel. Das extrinsische System reagiert durch Kontakt mit extravaskulärem Gewebsthromboplastin (Tissue Factor) mit einer Aktivierung des Faktor VII zu Faktor VIIa, der zusammen mit Kalzium den Faktor X zu Faktor Xa aktiviert. Hier mündet die extrinsische Gerinnungskaskade, zusammen mit der intrinsischen Gerinnungskaskade, in den gemeinsamen Endweg der plasmatischen Gerinnungskaskade.
Gemeinsame Endstrecke
Ab der Bildung von Faktor Xa verlaufen beide Schenkel der Gerinnungskaskade gemeinsam über die Verbindung von Faktor Xa und Faktor Va, der als Prothrombinase-Komplex bezeichnet wird. Dieser spaltet in Anwesenheit von Kalzium Prothrombin zu Thrombin (Faktor IIa), das sich von der Thrombozytenoberfläche löst und nun Fibrinogen zu Fibrinmonomeren spaltet. Die gleichzeitige Aktivierung von Faktor XIII durch Thrombin sorgt für die Quervernetzung der Fibrinmonomere zu Polymeren.
Des Weiteren stößt Thrombin durch die Aktivierung des Faktors XI die intrinsische Gerinnungskaskade an und fördert durch Aktivierung von Faktor V die Entstehung von mehr Prothrombinase-Komplexen.
Anschlussreaktionen
Wenige Minuten nach Bildung des fertigen Thrombus ziehen sich die Wundränder im Rahmen der Retraktion zusammen. Aus dem Blutkuchen wird dabei Serum herausgepresst, das mit dem Blutstrom abtransportiert wird. Der Abbau des Fibringerüsts erfolgt durch die Fibrinolyse.
Klinik
Störungen der Hämostase können sich sowohl als Neigung zur übermäßigen als auch in einer unzureichenden Hämostase äußern. Als Ursachen kommen Defekte auf der Ebene der Thrombozyten, der plasmatischen Gerinnung oder der Fibrinolyse infrage.
Erkrankungen mit einer erhöhten Blutungsneigung werden unter dem Begriff "Hämorrhagische Diathese" subsumiert. Krankheiten mit einer überschießenden Gerinnung werden unter dem Begriff "Thrombophilie" zusammengefasst.
Die Überprüfung der Blutgerinnung beim Patienten erfolgt im klinischen Alltag durch eine Reihe verschiedener Labortests, welche die Konzentration einzelner Gerinnungsfaktoren oder das intrinsische und/oder extrinsische System überprüfen, z.B.:
- Prothrombinzeit (Quick-Wert)
- Partielle Thromboplastinzeit (PTT)
- Thrombinzeit (TZ)
- Plasmafibrinogen
- International Normalized Ratio
- Thrombelastometrie
Podcast

Quiz
Bildquelle
- Bildquelle Podcast: © Midjourney
- Bildquelle Quiz: © Testalize.me / Unsplash