Emulgator
Englisch: emulsifier
Definition
Emulgatoren stabilisieren Gemische aus zwei nicht miteinander mischbaren Flüssigkeiten, sogenannte Emulsionen, indem sie die Grenzflächenspannung senken. Emulgatoren sind immer Tenside, umgekehrt wirken jedoch nicht alle Tenside als Emulgator.
Funktionsweise
Emulgatoren zeichnen sich dadurch aus, dass sie Emulsionen, also Gemische aus zwei nicht-mischbaren Flüssigkeiten, stabilisieren können.
Emulsionen sind physikalisch instabil, da die beiden Flüssigkeiten sich abstoßen und zwei einzelne, getrennt vorliegende Phasen bilden. Dies wird als "Brechen" bezeichnet. Das Brechen erfolgt dadurch, dass das Vorliegen zweier vollständig getrennter Phasen energetisch günstiger als die Emulsion ist. Bei einer Emulsion herrscht nämlich zwischen der inneren und äußeren Phase eine Grenzflächenspannung, die aufgrund der großen Oberfläche der inneren Phase hoch ist. Bei zwei getrennten Phasen ist die Kontaktfläche zwischen den Phasen und somit auch die Grenzflächenspannung minimal.
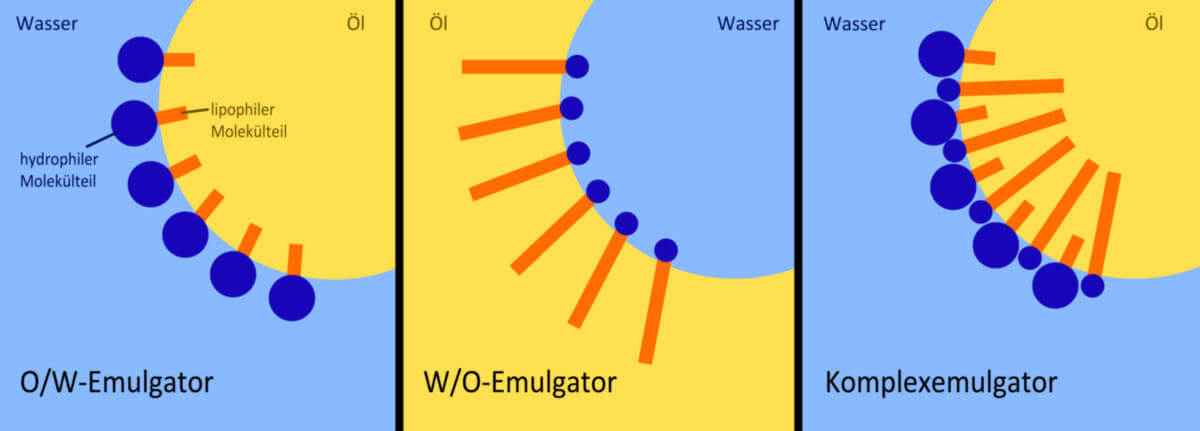
Emulgatoren wirken dadurch, dass sie als oberflächenaktive Substanz die Grenzflächenspannung herabsetzen. Dies erfolgt dadurch, dass Emulgatoren sowohl über einen hydrophilen als auch einen lipophilen Molekülteil verfügen, also sowohl in der Wasser- als auch in der Ölphase löslich sind. Der hydrophobe Molekülteil lagert sich in der Ölphase an, der hydrophile Teil in der wässrigen Phase. Hierdurch wird die Grenzflächenspannung zwischen den beiden Phasen herabgesetzt und die Emulsion energetisch stabilisiert.
Molekularstruktur
Nach Überschreiten der kritischen Mizellbildungskonzentration (CMC) bilden sich Mizellen aus. Wenn die Konzentration der Mizellen in der Flüssigkeit ansteigt, interagieren diese miteinander und es kommt zur Ausbildung eines flüssigkristallinen Systems, das auch als Mesophase oder Assoziationskolloid bezeichnet wird.
Emulgatoren bilden eine lyotrope Mesophase. Abhängig von Konzentration und Molekülstruktur können sich folgende Strukturen ausbilden, die mit einem Polarisationsmikroskop charakterisiert werden können:
- hexagonale Phase: Die Mizellen vereinen sich und bilden walzenähnliche, optisch anisotrope Strukturen. Im Polarisationsmikroskop sind sie als Patchwork-Muster erkennbar.
- lamellare Phase: Ab einer Tensidkonzentration von über 50% kommt es zur Ausbildung einer Schichten-Struktur. Im Polarisationsmikroskop zeigen sich sogenannter "Malteserkreuze".
- kubische Phase: Hat das Tensid stark polare Kopfgruppen, so bilden sich keine länglichen Assoziate. Stattdessen ordnen sich die Moleküle in einem kubischen Gitter an. Das bedeutendste Charakterisitikum ist die Ausbildung eines Brummgels, das bei mechanischer Beanspruchung leicht resoniert. Im Gegensatz zu den anderen Phasen ist die kubische Phase optisch isotrop und transparent.
Einteilung
Emulgatoren können nach ihrer Ladung eingeteilt werden:
Des Weiteren kann eine Einteilung nach der Hydrophilie erfolgen: Bei hydrophilen Emulgatoren überwiegt der hydrophile Molekülteil, bei lipophilen der lipophile Teil. Dies entscheidet darüber, welche Art an Emulsion sich bildet: Hydrophile Emulgatoren führen zur Bildung einer Öl-in-Wasser-Emulsion (O/W), lipophile Emulgatoren zu einer Wasser-in-Öl-Emulsion (W/O). Die Quantifizierung der Hydrophilie erfolgt über den HLB-Wert.
Komplexemulgatoren stellen Mischungen aus hydrophilen und lipophilen Emulgatoren dar. Sie führen zur Ausbildung einer (O/W)-Emulsion.
Eine weitere wichtige Kenngröße für Tenside ist die bereits erwähnte kritische Mizellbildungskonzentration, also die Konzentration, ab welcher die Oberfläche der Flüssigkeit vollständig mit Emulgatormolekülen bedeckt ist. Weitere Charakteristika sind die Phaseninversionstemperatur und der Trübungspunkt.
Vertreter
| Ladung | hydrophil | lipophil |
|---|---|---|
| neutral | Tween, Tagat, Kolliphor, Myrj, Brij, Poloxamere | höhere Fettalkohole, Sterole, Span, Tegin M, Tegin P |
| anionisch | Natriumstearat, Aminseifen, Fettalkoholsulfate (SDS), Lanette E, Salze der Gallensäure, Saponine, Gummi arabicum | Magnesiumstearat, Calciumstearat |
| kationisch | "Quats": Benzalkoniumchlorid, Cetylpyridiniumchlorid, Cetrimid | - |
| amphoter | Proteine, Lecithine, Tego | Lecithin (je nach Länge der Fettsäure) |
| Komplexemulgator | emulgierender Cetylstearylalkohol Typ A und B | - |
Verwendung
Emulgatoren spielen im Alltag eine wichtige Rolle:
- bei der tierischen Milchproduktion: Lecithin (Lösung von Milchfett in Wasser)
- bei der Verdauung: z.B. Gallensalze (Fettverdauung)
- im Hausgebrauch: Tenside (Spülmittel)
- in der Pharmazie: zur Herstellung von Cremes und zur Stabilisierung disperser Systeme
Alternativen
Nicht nur Emulgatoren können Emulsionen stabilisieren. Weitere Methoden sind:
- lyophile Kolloide: Lösungen von Makromolekülen gehen intensive Wechselwirkungen mit dem Lösungsmittel ein. Die Emulsion wird nicht durch einen Emulgator, sondern durch die erhöhte Viskosität der äußeren Phase stabilisiert. Man spricht von Quasiemulsionen. Verwendete Quasiemulgatoren sind Celluloseether, Gelatine, Stärke oder Gummi arabicum
- Feststoffemulgatoren: unlösliche Feststoffe bilden partikuläre Filme. Ähnlich wie die Quasiemulgatoren stabilisieren sie das Produkt über eine Viskositätserhöhung. Verwendet wird z.B. Bentonit, Kohlepulver, Aluminiumhydroxid und Magnesiumhydroxid.
Literatur
Bauer, Frömmig, Führer: Pharmazeutische Technologie. Mit Einführung in die Biopharmazie. 10. Auflage, Stuttgart 2017