Hämsynthese
Synonym: Hämbiosynthese
Englisch: h(a)eme synthesis
Definition
Unter dem Begriff Hämsynthese fasst man die biochemischen Prozesse zusammen, die zur Bildung der Komplexverbindung Häm führen. Sie sind ein Teil der Hämoglobinsynthese.
Hintergrund
Die Häm-Gruppe ist ein Bestandteil der Hämoproteine. Den größten Anteil der Hämsynthese betreiben erythroide Vorläuferzellen im Knochenmark (Proerythroblasten, Erythroblasten) sowie die Hepatozyten aufgrund ihrer großen Anzahl an P450-Cytochromen. Grundsätzlich ist aber jede Zelle zur Hämsynthese in der Lage. Die Hämsynthese erfolgt sowohl im Zytosol, als auch in den Mitochondrien. Häm ist die prosthetische Gruppe der Hämoproteine bzw. Cytochrome und ist essenziell für die Bindung des molekularen Sauerstoffs und seines Transportes durch den Körper.
Aufbau des Häms
Das Häm-Molekül ist der Porphyrin-Teil eines Hämoproteins. Die Grundstruktur besteht aus einem Ring aus vier Pyrrolringen (Tetrapyrrolring), die über Methinbrücken (-CH=) verknüpft sind. Weiterhin enthält dieser Porphyrin-Ring noch viele zusätzliche Doppelbindungen, Methyl-, Vinyl- und Propionsäuregruppen, sowie das zentrale Eisenion Fe2+, das durch die Stickstoff-Atome der Pyrrolringe komplexiert wird.
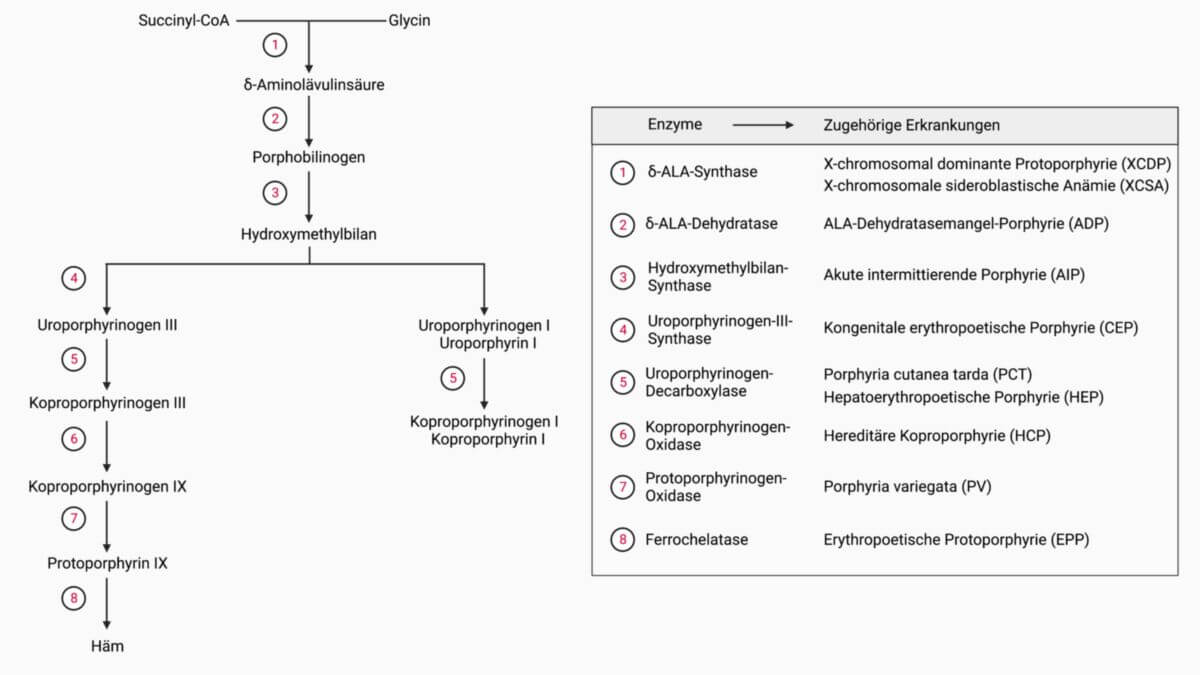
Ablauf der Hämsynthese
Mitochondriale Matrix
Der erste Schritt wird durch die δ-Aminolävulinsäure-Synthase (δ-ALAS) mit Pyridoxalphosphat als Coenzym katalysiert. Succinyl-CoA reagiert mit Glycin unter Abspaltung von Coenzym A zu α-Amino-β-ketoadipat, das spontan zu δ-Aminolävulinsäure (δ-ALA) decarboxyliert.
Zytosol
Innerhalb des Zytosols kondensieren zwei Moleküle δ-Aminolävulinsäure zu Porphobilinogen, katalysiert durch die δ-Aminolävulinsäure-Dehydratase (δ-ALAD). Über die Hydroxymethylbilan-Synthase kondensieren vier der Porphobilinogenmoleküle zu Hydroxymethylbilan. Hierbei werden vier Moleküle Ammoniak abgespalten.
Das entstandene Hydroxymethylbilan wird über die Uroporphyrinogen-III-Synthase zyklisiert und es entsteht Uroporphyrinogen III mit dem typischen Tetrapyrrolring.
Über die Uroporphyrinogen-Decarboxylase werden die Acetatgruppen aller vier Ringe zu Methylgruppen decarboxyliert und es entsteht Koproporphyrinogen III.
Weitere Prozessierung im Mitochondrium
Nachdem Koproporphyrinogen III wieder in das Mitochondrium gelangt ist, werden die Propionatseitenketten zu Vinylseitenketten dehydriert und decarboxyliert, woraus Koproporphyrinogen IX entsteht. Dieser Schritt wird durch die Koproporphyrinogen-Oxidase, die mit der mitochondrialen Innenmembran assoziiert ist, katalysiert. Molekularer Sauerstoff dient bei diesem Schritt als Wasserstoffakzeptor. Das Koproporphyrinogen IX ist durch den Verlust von sechs Carboxyl-Gruppen deutlich hydrophober.
Durch die Protoporphyrinogen-Oxidase werden die Methylengruppen, welche die Ringe verbinden, zu Methingruppen dehydriert. Das entstandene Tetrapyrrolsystem ist nun konjugiert und mit 11 Doppelbindungen versehen und wird Protoporphyrin IX genannt.
Der letzte Schritt besteht aus dem Einbau von Eisen. Die Ferrochelatase katalysiert diese Reaktion und baut ein zweiwertiges Eisenion in das Zentrum des Moleküls ein. Dieses Enzym befindet sich an der inneren Mitochondrienmembran. Dadurch entsteht ein Häm-Molekül.
Regulation der Hämsynthese
Regulation in der Leber
Die Regulation erfolgt über eine Rückkoppelungshemmung der δ-Aminolävulinatsynthase-1 über verschiedene Mechanismen:
- die δ-Aminolävulinatsynthase-Reaktion ist die geschwindigkeitsbestimmende Schritt der Porphyrinbiosynthese, da sie lediglich eine Halbwertszeit von ca. 30 min besitzt. Häm unterdrückt die Transkription des δ-ALA-Synthase-1-Gens. Bei Hämmangel kann die Enzymkonzentration im Gegenzug auf das fünfzigfache gesteigert werden.[1]
- Des Weiteren hemmt Häm den Transport des Proenzyms der δ-Aminolävulinatsynthase-1 über die Bindung am sogenannten hämregulatorischen Element, das diesen Import in der Folge verhindert.
Regulation in den Erythroblasten
Die Regulation erfolgt hier über eine Beeinflussung der δ-Aminolävulinatsynthase-2, ebenfalls über mehrere Mechanismen:
- Erythropoetin stimuliert die Transkription des δ-Aminolävulinatsynthase-2-Gens über Signaltransduktion. Eine große Rolle spielt hierbei die Trankriptionssteigerung unter Vermittlung des Transkriptionsfaktors GATA-1.
- Im Bereich der mRNA der δ-Aminolävulinatsynthase-2 befindet sich ein sogenanntes eisenregulatorisches Element (IRE), an das bei niedrigen Eisenkonzentrationen in der Zelle das eisenregulatorische Protein (IRP) bindet und damit die Translation der mRNA verhindert. Darüber hinaus wird die Transferrinrezeptor-mRNA vermehrt translatiert, was die Eisenaufnahme in die Erythroblasten fördert. Wenn die Eisenkonzentration in der Zelle wieder steigt, kann das IRP nicht mehr an das IRE binden und die Wechselwirkung entfällt.
Störungen der Hämsynthese
- Sideroblastische Anämie durch Störungen der δ-Aminolävulinatsynthase-2
- primäre Porphyrie durch angeborene Defekte der Enzyme der Hämsynthese
- sekundäre Porphyrie durch erworbene Pathologien der Enzyme der Hämsynthese
Quellen
- ↑ Müller et al. Porphyrine – Synthese und Abbau. Petrides Biochemie und Pathobiochemie. Springer-Lehrbuch. Springer, Berlin, Heidelberg 2014